radikalische Polymerisation
Die radikalische Polymerisation soll mit Hilfe des Beispiels Polyethylen PE (auch Polyethen genannt), welches aus dem Monomer Ethen entsteht, näher erläutert werden.
Vorraussetzung für den Beginn diese Polymerisation ist die Entstehung eines Radikals (reaktives Bruchstück mit ungebundenen Elektronen). Unter Einfluss von Temperatur entsteht aus dem Ethen ein Radikal.
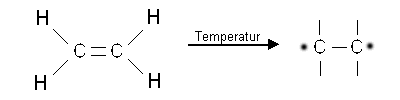
Dieses Radikal ist nun in der Lage eine der Doppelbindungen eines weiteren Ethen-Molekühls aufzubrechen (Beginn des Kettenwachstums).
Betrachtet man das Ethen-Molekühl näher, wird deutlich warum ein Aufbrechen möglich ist.
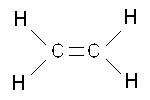
Die Doppelbindung zwischen den C-Atomen ist unterschiedlich stark ausgeprägt. Die feste der beiden Bindungen wird als σ-Bindung, die schwächere Bindung als π-Bindung bezeichnet. Dem Radikal gelingt es die schwächere Bindung aufzubrechen. Ein neues Radikal entsteht. Dieses Radikal ist jedoch stabiler, da es länger ist.
Das Kettenwachstum setzt sich solange fort, bis zwei Radikale aufeinandertreffen und somit der Radikalcharakter verschwindet.
Was entsteht, ist eine fadenförmiges Makromolekühl der folgenden Form:
...CH2-CH2-CH2-CH2-CH2-CH2...
(Polyethylen PE)
Der Polymerisationsgrad, also die Kettenlänge, ist dabei statistisch um einen Mittelwert verteilt.
Weitere bedeutenden Polymere:
- Polyvinylchlorid (PVC)
- Polystyrol
- Polypropylen (PP)

